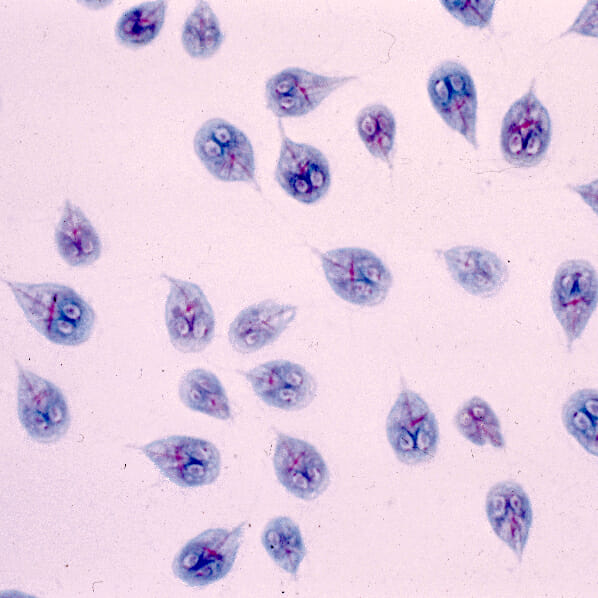
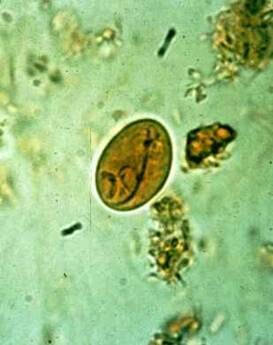
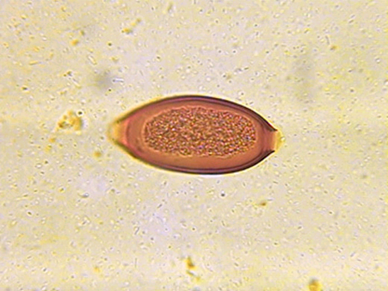
Description
APAFIX
Notre fixateur universel breveté pour les ovules et les larves d’helminthes/kystes et oocystes de protozoaires
Caractéristiques et avantages
- Simplifie le traitement des échantillons.
- Fixateur sans formol
- Aucune étiquette d’avertissement – Non toxique, non inflammable, respectueux de l’environnement
- Convient à toutes les fixations parasitologiques
- Préserve la morphologie même avec des organismes délicats
- Compatible avec la PCR et d’autres méthodes moléculaires
- Peut être utilisé en conjonction avec les EIA.
- Convient pour une utilisation avec une variété de techniques de coloration courantes
- Disponible en flacon de transport et flacons remplis Parasep®
10% FIXATEUR DE FORMAL DANS L’EAU
Ce conservateur est un bon fixateur global et fixera à la fois les ovules et les kystes bien qu’il ne préserve la morphologie interne des kystes que jusqu’à 6 mois, après quoi le cytoplasme de l’organisme devient granuleux avec une mauvaise définition nucléaire.
ACÉTATE DE SODIUM ACIDE ACÉTIQUE FORMALINE (SAF)
Le matériau fixe SAF convient à l’examen direct, à la concentration (formol/acétate d’éthyle) et à la coloration permanente.
.
MERTHIOLAT-IODE FORMALINE (MIF)
Les méthodes de concentration de formol-acétate d’éthyle peuvent être effectuées sur des échantillons conservés en MIF.
ALCOOL POLYVINYLIQUE (PVA)
Cette méthode préserve bien les ovules, les larves et les trophozoïtes, mais les kystes peuvent présenter une certaine distorsion. Cependant, certains ovules et kystes ne se concentrent pas bien lorsqu’ils sont conservés dans du PVA.
RÉACTIFS DE PARASITOLOGIE
GLYCÉRINE-ALBUMINE DE MAYER
La glycérine-albumine de Mayer est utilisée lors de la préparation des lames pour la coloration. L’albumine aide à garantir que l’échantillon adhère à la lame et la glycérine retient suffisamment d’humidité pour empêcher la déformation ou la perturbation des organismes lors du séchage.
SOLUTION TRITON X-100
Utilisé pour émulsionner les parasites dans les selles, pour une utilisation dans les protocoles Parasep® standard.
ACÉTATE D’ÉTHYLE
Un solvant qui élimine les graisses des selles, à utiliser dans les protocoles Parasep® standard.
ACÉTONE
Solvant
ROUGE NEUTRE
La solution aqueuse et le colorant peuvent être utilisés dans la technique de Gram.
TACHES DE PARASITOLOGIE
EOSINE/SALINE
Cette coloration est utile pour la détection des trophozoïtes mobiles des espèces d’Entamoeba
ORANGE D’ACRIDINE (TAMPONNÉ ACÉTATE)
L’ajout d’orange d’acridine à un concentré fécal met en évidence les barres chromidiennes d’Entamoeba coli, Entamoeba histolytica/dispar et Entamoeba hartmanni, qui émettent une fluorescence vert vif.
AURAMINE PHÉNOL (LEMPERT)
Méthode
1. Faire des frottis fécaux comme pour le ZN et les fixer dans du méthanol.
2. Colorer à l’Auramine-Phénol (Lemperts) pendant 10 à 15 min.
3. Rincer abondamment à l’eau du robinet.
4. Décolorer dans l’alcool acide (comme pour le ZN).
5. Rincer abondamment à l’eau du robinet.
6. Contre-colorer avec du permanganate de potassium à 0,1% pendant 30 secondes.
7. Rincer abondamment à l’eau du robinet, laisser sécher à l’air. Ne pas sécher, de nombreuses marques de papier buvard seront fluorescentes !
Les oocystes apparaissent sous forme de disques jaune vif sur un fond sombre.
SOLUTION A ET SOLUTION B DE TACHES DE TERRAIN
NB Les deux solutions sont prêtes à l’emploi et ne doivent pas être diluées.
Cette technique est une méthode de coloration de Field rapide, qui permet une coloration rapide de films minces fixés de divers échantillons cliniques. Cette méthode particulière est très utile pour colorer des films de matières fécales non formées, d’exsudats fécaux, d’aspirations duodénales, etc.
Méthode
1. Faire une fine pellicule de matières fécales/exsudat et laisser sécher.
2. Fixer dans du méthanol pendant 1 min.
3. Inonder la lame avec 1 ml de Field’s Stain B .
4. Ajouter immédiatement un volume égal de Field’s Stain A bien mélanger sur la lame et laisser colorer pendant 1 min.
5. Bien rincer à l’eau du robinet et égoutter à sec.
6. Examinez le film à l’aide de l’objectif à immersion d’huile et de l’huile d’immersion
Résultats
Noyaux et structures parasitaires contenant de la chromatine – rouge
Cytoplasme – gris bleuté
Noyaux leucocytaires – violet
Levures et bactéries – bleu foncé
TEINTURE GIEMSA RAPIDE
Le colorant Giemsa peut également être utilisé pour colorer des films de matières fécales non formées, d’exsudat fécal, d’aspiration duodénale, etc.
IODE DE LUGOL – AQUEUX
Coloration temporaire pour protozoaires.
HÉMATOXYLINE DE FER – SOLUTION A ET SOLUTION B
Préparation de la solution de travail d’hématoxyline de fer –
Méthode
1. Mélanger des volumes égaux des deux solutions et filtrer.
2. Laisser reposer au moins deux heures (de préférence une nuit) avant utilisation afin que la réaction chimique soit complète. La coloration est optimale 3 à 5 jours après la préparation.
Si la solution d’hématoxyline de fer est utilisée immédiatement après la préparation, les parasites peuvent être colorés en bleu intense avec peu de différenciation des détails nucléaires.
Lorsque le colorant Iron Haematoxylin est mature (généralement 3 à 5 jours après la préparation), le fond doit devenir gris avec les protozoaires bleu clair et les noyaux bleu-noir. La coloration de fond de la lame dépend de la composition de l’échantillon.
La teinture est normalement utilisable pendant une semaine. La durée de conservation peut être prolongée en le stockant dans un flacon bouché dans l’obscurité après chaque utilisation.
TRICHROME POUR MICROSPORIDIE
Méthode
1. Faire des frottis à partir d’échantillons de selles non concentrés dans du formol à 10 % (rapport 1:3).
REMARQUE : assurez-vous que les frottis sont extrêmement minces.
2. Fixer dans du méthanol pendant 5 minutes.
3. Colorer au trichrome modifié (code 1489) pendant 90 min.
4. Rincer à l’alcool acide pendant 10 secondes.
5. Rincer brièvement dans de l’alcool à 95 %.
6. Placer dans de l’alcool à 95% pendant 5 minutes.
7. Placer dans de l’alcool à 100% pendant 10 minutes.
8. Clair dans du xylène pendant 10 minutes.
9. Examiner sous un objectif à immersion d’huile x 100, en utilisant de l’huile à immersion.
Interprétation Les
spores des microsporidies sont ovoïdes et réfractiles et la paroi des spores se colore d’un rouge rosâtre brillant. Parfois, le contenu cellulaire de certaines spores ne se tache pas et semble transparent, d’autres présentent une ceinture teintée de rouge rosâtre ceignant les spores en diagonale ou à l’équateur. Les spores mesurent environ 1,5 sur 0,9 µ. Les débris de fond et les bactéries sont contre-colorés en vert pâle.
TRICHROME POUR PROTOZOAS
Peut être utilisé pour colorer des matières fécales fraîches, des matières fécales préfixées (seulement certains fixateurs) ou des organismes cultivés. La méthode varie légèrement selon la préparation d’échantillon utilisée.
VERT MALACHITE
Le vert malachite est une contre-coloration verte utilisée pour différencier les bactéries.
PACK DE TACHES Z/N MODIFIÉ (COLD KINYOUN)
Méthode suggérée
- Inonder les frottis thermofixés de Carbol Fuchsin (ZN) et cuire doucement à la vapeur pendant 5 minutes.
Ajoutez plus de teinture si nécessaire pour éviter le dessèchement.
2. Laver à l’eau et décolorer à l’alcool acide jusqu’à ce que le colorant ne coule plus de la lame.
3. Laver à l’eau et contre-colorer pendant 10 à 30 secondes avec du bleu de méthylène ou du vert malachite.
4. Laver, éponger et examiner.
Les organismes acido-résistants se colorent en rouge, le fond et les autres organismes se colorent en bleu
RÉACTIFS DE TEINTURE DE MICROBIOLOGIE
PROTOCOLE DE TACHES DE GRAM
Grams Iode – Cristal Violet
Safranin O – Rouge Neutre
Fuchsine de Gram – Décolorant de Gram
Gram’s Stain distingue les deux grandes classes de bactéries en raison des différences de structure de la paroi cellulaire ;
Les bactéries Gram-positives, restent colorées après la procédure de coloration, et les bactéries Gram-négatives, qui ne retiennent pas le colorant.
Dans la technique de coloration, les cellules sur une lame de microscope sont fixées à chaud et colorées avec un colorant basique, Crystal Violet, qui colore toutes les cellules bactériennes en bleu. Une solution d’iodure est ensuite ajoutée qui permet à l’iode de pénétrer dans les cellules et de former un complexe insoluble dans l’eau avec le colorant Crystal Violet. La préparation est ensuite traitée avec un solvant de décoloration, dans lequel le complexe iode-cristal violet est soluble.
Après le traitement au solvant, seules les cellules gram-positives restent colorées, peut-être à cause de leur paroi cellulaire épaisse, qui n’est pas perméable au solvant. Après la procédure de coloration, les cellules sont traitées avec un contre-colorant qui peut être de la safranine O, de la fuchsine de Gram ou du rouge neutre. Les cellules gram-négatives contre-colorées apparaissent en rouge et les cellules gram-positives restent bleues.
Bien que les parois cellulaires des bactéries gram-négatives et gram-positives aient une composition chimique similaire, la paroi cellulaire des bactéries gram-négatives est une fine couche prise en sandwich entre une enveloppe cellulaire externe contenant des lipides et la membrane cellulaire interne, tandis que les bactéries gram- la paroi cellulaire positive est beaucoup plus épaisse, n’a pas d’enveloppe cellulaire et contient des substances supplémentaires, telles que des acides téichoïques, des polymères composés de glycérol ou de ribitol.
La différence de réactivité entre les bactéries gram-positives et gram-négatives est liée aux différences de propriétés physiologiques des deux groupes. Les bactéries Gram-positives sont généralement plus sensibles à l’inhibition de la croissance par les colorants, les halogènes, de nombreux antibiotiques, et à l’attaque par la phagocytose et sont plus résistantes à la digestion par la pepsine et la trypsine de l’enzyme et les enzymes dans les sérums animaux.
PACK DE TACHES DE GRAMME
Contenu
A Violet cristal
B Grammes Diluant d’iode
C Grammes Concentré d’iode
D Grammes Décolorant
E Contre-coloration : au choix (Safranine O, Rouge neutre ou Fuchsine de Gram)
Remarque
Le concentré de grammes d’iode (C) doit être ajouté au diluant (B) et bien mélangé avant utilisation. Toutes les solutions sont maintenant prêtes à être utilisées dans des flacons compte-gouttes.
L’IODE DE LUGOL
L’ajout d’iode à un concentré de selles met en évidence les inclusions internes des kystes ; par exemple les noyaux et la masse de glycogène, facilitant ainsi leur identification.
Par exemple, l’ajout d’iode améliore la réfraction des noyaux d’ Endolimax nana , colore la chromatine périphérique des noyaux des espèces d’ Entamoeba et démontre la masse de glycogène bien définie qui est une caractéristique des pré-kystes ou des kystes immatures si E. coli et kystes de Iodamoeba butschlii .
VIOLET CRISTALLISÉ
Coloration de Gram primaire La solution Crystal Violet est une coloration violette utilisée pour différencier les bactéries.
SAFRANINE O
La safranine O est un colorant rouge utilisé pour différencier les bactéries, utilisé dans la technique de Gram.
GRAM’S FUCHSINE
Utilisé dans la technique de Gram
L’IODE DE LUGOL
Utilisé dans la technique de Gram
DÉCOLORANT GRAMMES
Utilisé dans la technique de Gram